直接電位法檢測水質的工作原理
發布時間:2020/11/26 14:42:17 來源:貫奧儀器儀表 作者:便攜式多參數水質分析儀器 閱讀次數:
水質檢測時所用的直接電位法是通過測量原電池中電動勢進行定量分析的方法,在電位法中原電池有兩個電極構成。一個指示電極,其電位會隨著被測離子的濃度而變化,它能夠指示出被測離子的濃度。另一個是參比電極,其電位不受試液組成的變化影響,具有比較恒定的數值。當指示電極和參比電極共同浸入檢測樣品所構成的原電池時,通過測定原電池的電動勢,用電極電位基本公式即可求得被測離子的濃度。
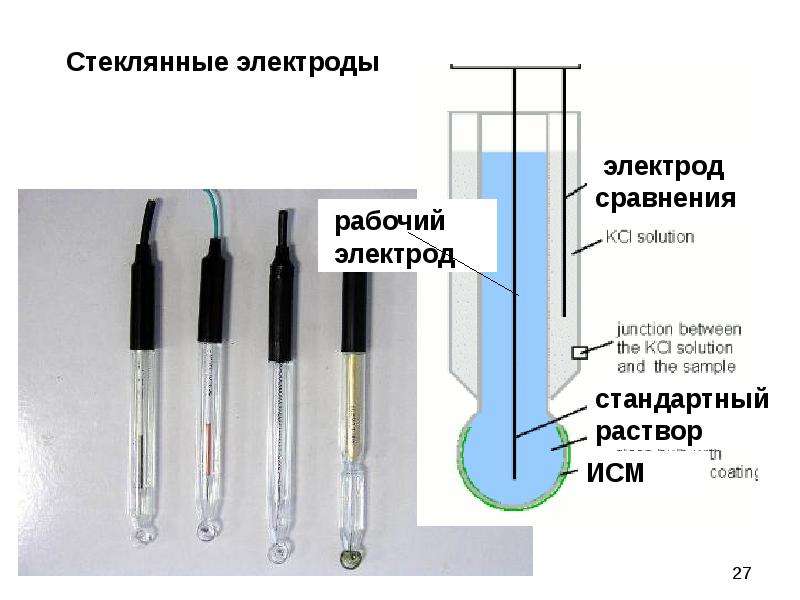
1.水質檢測時所用指示電極的分類
1)第一類電極由金屬浸在同種金屬離子的溶液中構成。這類電極能反映陽離子濃度的變化,如銀絲插入銀絲溶液中組成銀電極,其電極反應和電位為
Ag+ + e=Ag E= E0 +0.0591[Ag+]
此銀電極不但可用于測定銀離子的濃度,而且還可用于因沉淀或配合等反應而引起的銀離子濃度變化的電位滴定。
2)第二類電極由金屬及其難溶鹽的陰離子溶液構成。這類電極能間接反映與金屬離子生成難溶鹽的陰離子的濃度,如 Ag-AgCl電極可用于測定C的濃度。其電極反應和電位反應如下
AgCl + e-= Ag+Cl- E=E0AgCl/Ag-00591[CI]
3)惰性金屬電極由一種性質穩定的惰性金屬,如鉑電極。在溶液中,電極本身并不參與反應,僅作為導體,是物質的氧化態和還原態交換電子的場所。通過它可以顯示出溶液中氧化還原體系的平衡電位。如鉑絲插入含有Fe3+和Fe2+的溶液組成惰性鉑電極,其電極反應和電極電位為:Fe3+ + e- = Fe2+
4)膜電極這類電極是以固態或液態膜作為傳感器,它能指示溶液中某種離子的濃度。膜電位和離子濃度符合能斯特方程式的系。但是,膜電極的產生機理不同于上述各類電極,其電極上沒有電子的轉移,而電極電位的產生是由于離子的交換和擴散的結果。各種離子選擇性電極就屬于這類指示電極,如玻璃電極。
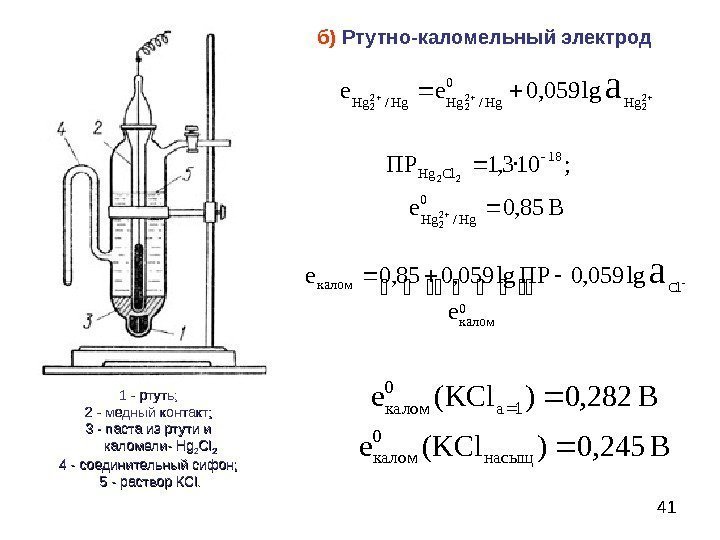
2.水質檢測時所用的參比電極
參比電極是測量電極電位的相對標準。因此要求參比電極的電極電位恒定、再現性好。通常把標準氫電極作為參比電極的一級標準。但因制備和使用不方便,已很少用它作參比電極,取而多孔物質代之的是易于制備、使用又方便的甘汞電極和銀一氯化銀極。
實際工作中最常用的是甘汞電極,它是由金屬汞和甘汞Hg2Cl2及KCl溶液等構成。電極由兩個玻多孔物質璃套管組成。內玻璃管中封一根鉑絲,插入純汞中,下置一層甘汞和汞混合的糊狀物。外玻璃管中裝入KCl溶液。電極下端與待測溶液接觸部位是素燒陶芯或玻璃砂芯等微孔物質,構成使溶液互相連接的通路
甘汞電極電極反應為:Hg2 Cl2+2eF 2Hg+2CI
電極電位為: E=E-0.0591[C1 ]或E=E0+0.0591CcL-

