水的硬度是指水中Mg2+、Ca2+濃度的總量,是水質的重要指標之一。硬度可以分為暫時硬度和永久硬度:暫時硬度指由Ca(HCO3)2、Mg(HCO3)2或CaCO3、MgCO3形成的硬度,可加熱煮沸去除;永久硬度主要指CaSO4、MgSO4、CaCl2、MgCl2等形成的硬度。
一般天然地表水中硬度較小,如長江水為4~7度,松花江水月平均硬度2~3度,地下水、咸水、海水的硬度較大,一般為10~100度,有的甚至可能達到幾百度。而今天就來介紹一些配位滴定法檢測水中硬度的方法。

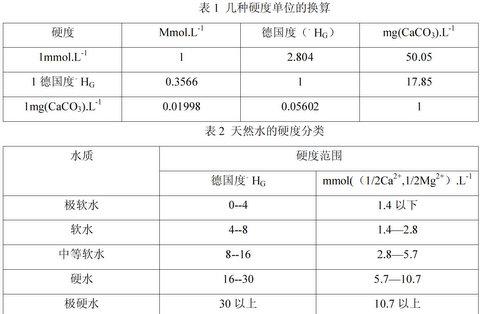
1)mmol/L。這是現在硬度的通用單位。
2)mg/L(以CaCO3計)。1mmol/L=100.1mg/L(以CaCO3計)。我國飲用水中總硬度不超過450mg/L(以CaCO3計)。
3)德國度(簡稱度)。1德國度相當于10mg/LCaO所引起的硬度,即1度。通常所指的硬度是德國硬度
1度=10mg/L(以CaO計)
1mmol/L(CaO)=56.1÷10=5.61(度)
1度=100.1÷5.61=17.8(mg/L)(以CaCO3計)
水中總硬度的測定,目前常采用EDTA配位滴定法。在pH=10的氨性緩沖溶液條件下,以鉻黑T為指示劑,用EDTA標準溶液進行滴定。其測定原理如下:
在pH=10的氨性緩沖溶液條件下,指示劑鉻黑T和EDTA都能與Mg2+、Ca2生成配合物,且配合物穩定程度順序為CaY2>MgY2>MgIn>Caln。在加入指示劑鉻黑T時鉻黑T與試樣中少量的Mg2+、Ca2+生成紫紅色的配合物:
Mg2++HIn2- ?MgIn-+H+
Ca2++HIn2-?CaIn-+H+
滴定開始后,EDTA首先與試樣中游離的Mg2+、Ca2+配位,生成穩定無色的MgY-和CaY2-配合物:
H2Y2-+Mg2+ ? MgY2-+2H+
H2Y2-+Ca2+ ?CaY2-+2H+
當游離的Ca2+、Mg2+與EDTA配位完全后,由于CaY2-、MgY2-配合物的穩定性遠大于CaIn-、MgIn-配合物,繼續滴加的EDTA會奪取CaIn、Mgln-配合物中的Ca2+、Mg2+,使鉻黑T游離出來,溶液由紫紅色變為藍色,指示滴定終點。反應
如下:
H2Y2- + MgIn ? MgY2- + HIn2-+H+
H2Y2- + CaIn-?CaY2-+HIn2-+H+
根據EDTA標準溶液的濃度及滴定時的用量,即可計算出總硬度:
總硬度(mmol/L)= CEDTA VEDTA/V
式中 CEDTA-EDTA標準溶液的濃度,mol/L;
VEDTA-EDTA標準溶液的體積,ml;
V—原水樣的體積,ml。
從上述反應可看出,在測定過程中的每一步反應都有H+產生,為了控制滴定條件為pH=10,使EDTA與Ca2+、Mg2+形成穩定的配合物,所以必須使用氨性緩沖溶液穩定溶液的pH值。這就使用配位滴定法檢測水中硬度的整個過程。
上一篇:檢測水中金屬離子時消除干擾的方法