酸堿滴定法是以酸堿反應為基礎的滴定分析法。是主要、基本的滴定分析方法之一。酸堿反應的實質是質子轉移的反應。根據酸堿質子理論,凡是能夠給出質子的物質就是酸,凡是能夠接受質子的物質就是堿。例如氫氧化鈉與鹽酸的反應,其反應方程式為:NaOH+HCL?NaCL+H2O。其中給出質子的物質是鹽酸(HCL),接收質子的物質是堿:氫氧化鈉。
用酸堿滴定法可以檢測酸、堿以及能與酸堿起反應的物質含量,因此在檢測水質pH值時也多用這種方法。該方法一般采用強酸或者強堿作為滴定劑,例如用HCL、H2SO4作為酸標準溶液,可以滴定具有堿性的物質,如果用CO2、H3PO4等。水質檢測時要使用滴定法獲得準確的分析結果,就必須掌握選擇適當的指示劑,使滴定終點盡可能地接近計量點。

酸堿滴定過程中,溶液本身不發生任何外觀的變化,所以常借助酸堿指示劑顏色的突然變化來指示確定終點。酸堿指示劑是一種具有復雜結構的有機弱酸(用符號HIn表示)或有機弱堿(用符號InOH表示),也有兩性的。它們具有一個共同的特點是:當溶液中H濃度發生變化時,能發生顏色的變化。這是由于指示劑本身在不同的pH值條件下,可以有幾種不同的結構,而不同的結構則顯示出不同的顏色,因此當溶液的pH值發生變化時,就引起了顏色的變化。例如酚酞,它是一種非常弱的有機酸,若以HIn表示其分子,在溶液中存在著以下的電離平衡:InOH?H+In。
酚酞在電離的同時發生結構的變化,即分子和離子的結構不同,因而電離生成的離子與未電離的分子具有不同的顏色,分子HIn是無色的,而離子In是紅色的。如果在溶液中加入酸或堿,就會影響分子與離子之間的電離平衡,在酸性溶液中,由于大量H的存在,平衡向左移動,酚酞主要以分子形式存在而呈無色;在堿性溶液中,由于H濃度降低,上述平衡向右移動,酚酞主要以離子的形式存在而呈紅色
又如甲基橙,它是一種有機弱堿,用InOH表示其分子,其分子是黃色的,離子是紅色的。在水溶液中存在以下的電離平衡:InOH?OH+In
在酸性溶液中,平衡向右移動,溶液呈現出紅色。在堿性溶液中,平衡向左移動,溶液呈現出黃色。
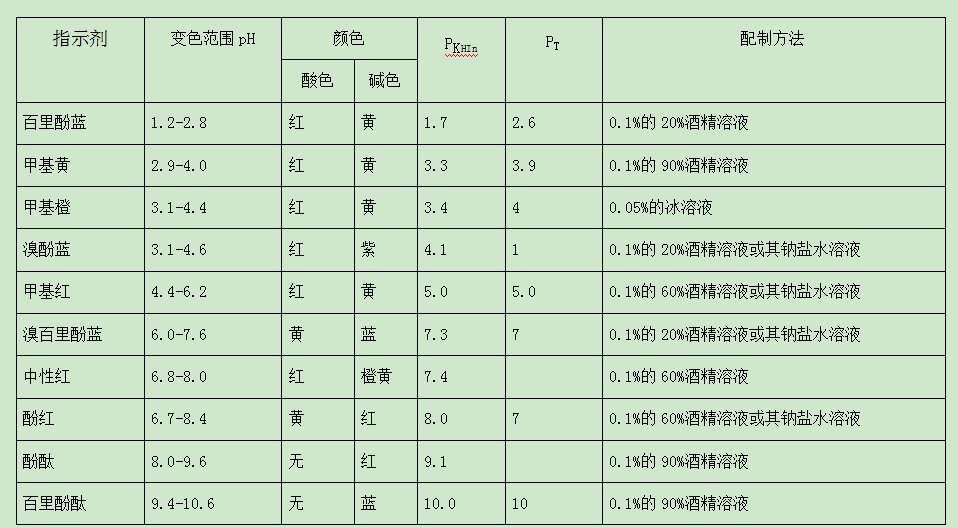
其他酸堿指示劑變色原理與酚酞及甲基橙類似。實際上不是溶液的pH值稍有變化就能觀察到指示劑顏色的變化,必須是溶液pH值改變到一定的范圍,指示劑顏色的變化才能被觀察到,這一范圍,就是指示劑的變色范圍。
上一篇:水質檢測時污水采樣的方法
下一篇:水質檢測儀的一般溶液配制方法