在保養水質檢測儀的電極時緩沖液是必須要準備的物品。它最常用的功能就是保持電極校準溶液的性質不會出現變化,比如在校準PH電極時就必須要用到它。該溶液通常由弱堿和其共軛酸(或弱酸及其共軛堿)組成,例如校準水質檢測儀的ph電極時這種溶液可以平衡酸堿度。這樣就能更好的控制ph反應,簡單的來說緩沖溶液是即使加入少量酸/堿后也能時pH值不變的溶液。今天我們主要想為大家介紹校準ph電極時緩沖液的工作原理。
堿緩沖液的作用:堿性緩沖液含有弱堿(BOH)及其與強酸(BX)的鹽。因此,除了H3O +和OH-之外,緩沖溶液含有大量的弱堿性BOH和陽離子B +(來自鹽BX的離解)。
向堿性緩沖液中加入酸或堿導致下列反應:
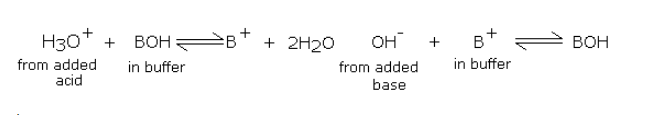
在校準水質檢測儀的ph電極時,緩沖溶液中加入酸或堿確實引起緩沖酸(或堿)和鹽的濃度變化,但由于緩沖溶液中這些濃度相對高得多,所以緩沖液的酸或堿的比例不會出現變化。
酸性緩沖液的作用:酸性緩沖液含有相對大量的弱酸(HA)及其鹽與強堿(如NaA)。因此,除了H3O +和OH-以外,緩沖溶液含有大量的HA和A-(由于鹽的離解)。
加入少量強酸會引起反應,
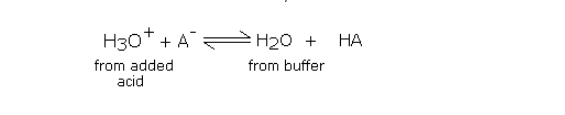
以等量的>A與H3O +結合得到相同量的未離解的弱酸HA的方向進行。因此,加入的酸被緩沖液中高濃度的陰離子(來自鹽)吸收。只要添加的強酸量較少,鹽濃度和弱酸(HA)的濃度變化就很小。因此,通過向緩沖溶液中加入強酸,酸與鹽的比例不會明顯變化。
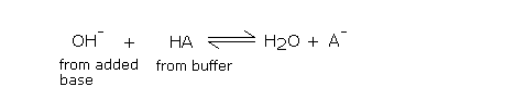
以正向進行添加,能導致以緩沖酸為代價形成等量的鹽。只要加入很小的堿量,弱酸與鹽的比例就基本保持不變,而pH值的的變化基本不會太大。
以上就是校準ph電極時緩沖液的工作原理,大家在了解之后可以多加利用。
上一篇:操作PH水質檢測儀時六個技術提示